Powstawanie wyrośli:
Najczęściej do rozpoznania HMO dochodzi w pierwszej dekadzie życia pacjenta. Miejscami gdzie najłatwiej i najwcześniej zauważamy wyrośla jest łopatka i piszczel – ze względu na skąpą tkankę podskórną w tych lokalizacjach.
Wyrośla mogą mieć charakter uszypułowany lub siedzący, tj. szerokopodstawny. Najczęściej wyrośla powstają w dalszej części uda i bliższej piszczeli 70-98% pacjentów, nieco rzadziej w strzałce 30-97%. Wyrośla wpływają na chrząstkę wzrostową prowadząc do zahamowania wzrostu i deformacji wielowymiarowych. Wyrośla powstają do czasu zamknięcia chrząstek wzrostowych i zakończenia dojrzewania szkieletowego. Do czasu osiągnięcia dojrzałości pacjenci często przechodzą kilkanaście zabiegów chirurgicznych.
Objawy kliniczne:
1. Ból – związany z tarciem tkanek miękkich (mięśni, naczyń, nerwów) o ostre zakończenia wyrośli.
2. Kaletki – nad wyroślami mogą tworzyć się przestrzenie płynowe na wskutek przewlekłego podrażnienia tkanek, wypełnione płynem surowiczym lub krwistym. Kaletki mogą ulegać zapaleniu powodując ból i duże deformacje obrysu.
3. Złamania wyrośli – szczególnie zagrożone są wyrośla na cienkich i długich szypułach. Do złamania może dojść wskutek bezpośredniego urazu lub nagłego napięcia mięśnia.
4. Irytujące dla pacjenta przeskakiwania, trzaskania wynikające z przemieszczenia się tkanek miękkich nad wyroślą.
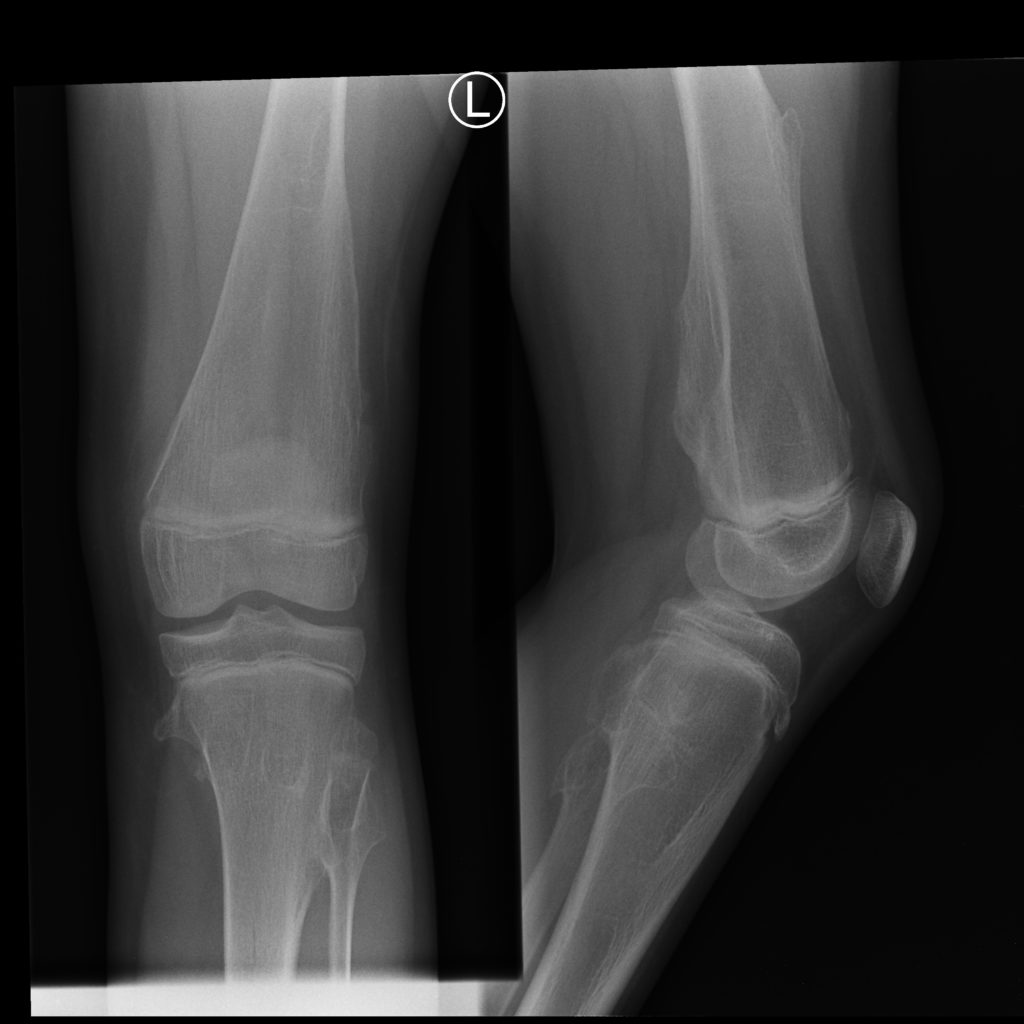
5. Ograniczenie zakresu ruchu – najczęściej są dotknięte staw kolanowy i łokieć. Wyrośla zlokalizowane blisko końców kostnych mogą stanowić mechaniczną przeszkodę przy zgięciu i wyproście.
6. Ucisk lub wciągnięcie nerwu z jego porażeniem – przykładem są wyrośla bliższej części strzałki prowadzące do zaburzenia funkcji nerwu strzałkowego i powstania objawu opadania stopy. Do takich powikłań może dojść przy konflikcie wyrośli z nerwem w każdej w zasadzie lokalizacji.
7. Ucisk na naczynia żylne i tętnicze z ryzykiem powstania malformacji naczyniowych żylnych i zagrażających życiu tętniaków i pseudo-tętniaków. Są to sytuacje, kiedy na wskutek tarcia dochodzi do przerwania ciągłości ściany naczynia i wylewy krwawego do tkanek. W przypadku niskociśnieniowego wypływu żylnego mamy do czynienia z powstaniem skąpoobjawowego krwiaka ale przypadku wypływu krwi tętniczej przebieg może być znacznie bardziej niebezpieczny.
8. Ucisk na rdzeń kręgowy – jest to rzadka sytuacja, ale piśmiennictwo podaje pojedyncze przypadki wyrośli wewnątrzkanałowych powodujących ucisk rdzenia i korzeni nerwowych.
9. Ucisk na moczowody, jelita – w przypadku dużych wyrośli w obrębie miednicy.
10. Krwawienia do klatki piersiowej i uszkodzenia tkanki płucnej – spowodowane ostrymi drobnymi wyroślami zlokalizowanymi na wewnętrznej powierzchni żeber. Tego typu wyrośla są możliwe do zlokalizowania przy użyciu Rezonansu magnetycznego (MRI) lub tomografii komputerowej (TK)
11. Niski wzrost – ok. 40% pacjentów ma wzrost poniżej 5 percentyla. Wiąże się to głównie z uszkodzeniem chrząstek wzrostowych okołokolanowych.
12. Deformacja koślawa kolan i stawów skokowych – może być związana zarówno z pierwotnym uszkodzeniem chrząstki wzrostowej przez wyrośla oraz z ich uszkodzeniem jatrogennym ( czyli podczas chirurgicznego usuwania wyrośli)
13. Ryzyko nierówności kończyn dolnych – podobnie jak w wypadku deformacji osiowych, nierówność może mieć charakter pierwotny lub wtórny do uszkodzeń pooperacyjnych
14. Deformacje przedramienia, nadgarstka i ręki – często są to deformacje związane z niestabilnością nadgarstka i ręki. Szerzej temat został opisany w zakładce ręka i przedramię.
15. Skolioza – w przypadku wyrośli kręgowych może dochodzić do skrzywienia bocznego kręgosłupa.
16. Biodra koślawe – w przypadku obecności wyrośli w okolicy szyjki kości udowej konieczne jest regularne monitorowanie w RTG zborności stawów biodrowych, ze względu na ryzyko powstania podwichnięcia lub nawet zwichnięcia stawu.
17. Dysplazja panewki biodra jest także opisywania w przypadku HMO jako skutek trwałej lateralizacji (wysunięcia bocznego) lub podwichnięcie biodra.
18. Zmiany zwyrodnieniowe stawów związane głównie z niestabilnością i podwichnięciem stawów oraz zmianami kształtu końców stawowych kości.
19. U około 2-5 % pacjentów dochodzi do transformacji w chondrosarcoma – mięsaka chrzęstnopochodnego – nowotworu o miejscowej złośliwości, który jest oporny zarówno na chemio- jak i radioterapię. Na szczęście większość tych mięsaków udaje się skutecznie wyleczyć za pomocą szerokiej chirurgicznej resekcji (wycięcia).
Czaszka i twarz
W historii publikacji na temat HMO tylko raz opublikowano przypadek wyrośli kości okrywy czaszki, natomiast nigdy nie opisano wyrośli kości twarzoczaszki. Jest to związane z innym typem kostnienia kości czaszki na tzw. podłożu błoniastym, w przeciwieństwie do tzw. kostnienia śródchrzęstnego w kościach długich.
Przedramię
Deformacja przedramienia występuje u 30% pacjentów z HMO.
Podstawową klasyfikację zaburzeń budowy przedramienia w przebiegu HMO przedstawił Masada i wsp. w roku 1989, później tę klasyfikację rozbudował w swojej pracy Gottshalk w roku 2012. Poniżej przedstawiam klasyfikację jaką zaproponował Masada, bo to ona jest najczęściej używana do oceny stanu przedramion pacjentów z HMO.
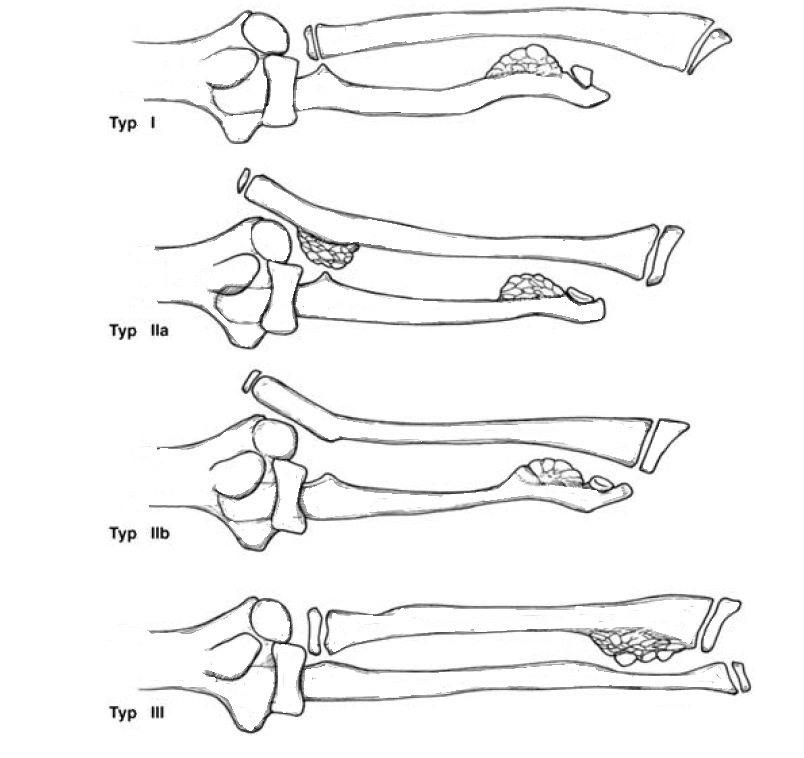
Amin Abdel Razek Youssef Ahmed ; Journal of Pediatric Orthopaedics 2019 Jan;28(1):67-72. Gradual ulnar lengthening by an Ilizarov ring fixator for correction of Masada IIb forearm deformity without tumor excision in hereditary multiple exostosis: preliminary results.
Każdy klinicysta zajmujący się HMO powinien znać klasyfikację Masady, gdyż daje ona wytyczne co do dalszego postępowania chirurgicznego.
W zależności od typu przedramienia wg Masady możemy się spodziewać następujących zaburzeń ruchu:
- Typ I – ograniczenie rotacji przedramienia ale dobry ruch łokcia
- Typ II – zaburzenie zarówno rotacji przedramienia i ruchu łokcia
- Typ III – dobry ruch przedramienia i łokcia ale silna i bolesna ulnaryzacja (odchylenie w stronę łokciową) nadgarstka z jego podwichnięciem
Masada poszedł o krok dalej i zaproponował konkretne postępowanie w zależności od zakwalifikowania typu przedramienia.

Podejście operacyjne w deformacjach przedramienia pozostaje kontrowersyjne. W bazie naukowej Pubmedu można odnaleźć zarówno artykuły wskazujące potrzebę elektywnych (planowych) zabiegów korekcji przedramienia jak i takie, których autorzy w badaniach dużych grup pacjentów nie znaleźli korzystnych skutków funkcjonalnych po tych zabiegach. Jeden fakt natomiast nie podlega dyskusji – tzn. konieczność korekcji chirurgicznej w razie zagrażającego podwichnięcia lub zwichnięcia głowy kości promieniowej. Blake C. Meza w pracy z 2020 roku dowodzi, że „nie wszystkie deformacje zyskują na operacji. Należy operować tylko pacjentów z zagrażającym lub obecnym podwichnięciem głowy kości promieniowej i odpowiednio oceniać ryzyko”.
Przeoczenie lub niezaopatrzenie destabilizacji stawu łokciowego wiąże się dla pacjenta ze znacznymi zaburzeniami ruchu, bólem, zmianami zwyrodnieniowymi łokcia. Dlatego niezwykle ważne jest poznanie czynników ryzyka powstania zwichnięcia głowy kości promieniowej. Na szczęście dysponujemy szeregiem narzędzi w postaci pomiarów dokonanych przez Burgassa i wsp. i oznaczeniami wyliczonymi przez Gindharta, które pozwalają nam z ogromnym prawdopodobieństwem takie ryzyko określić. Niniejsza strona nie jest odpowiednim miejscem do zagłębiania się w takie szczegóły, niemniej jednak pamiętać należy o wykonaniu zdjęć RTG w prawidłowych projekcjach (supinacji, pronacji i bocznej) i bardzo szczegółowych pomiarach tychże zdjęć przez lekarza badającego.
Obecnie za bezpośrednie wskazania do zabiegu operacyjnego należy uznać:
1.Typ II Masady z niestabilnością PRUJ (proximal radioulnar joint – bliższy staw promieniowo-łokciowy)
2. Podwichnięcie lub zwichnięcie głowy kości promieniowej zarówno przewlekłe jak i nawracające
3. Bolesne zmiany zwyrodnieniowe stawu łokciowego
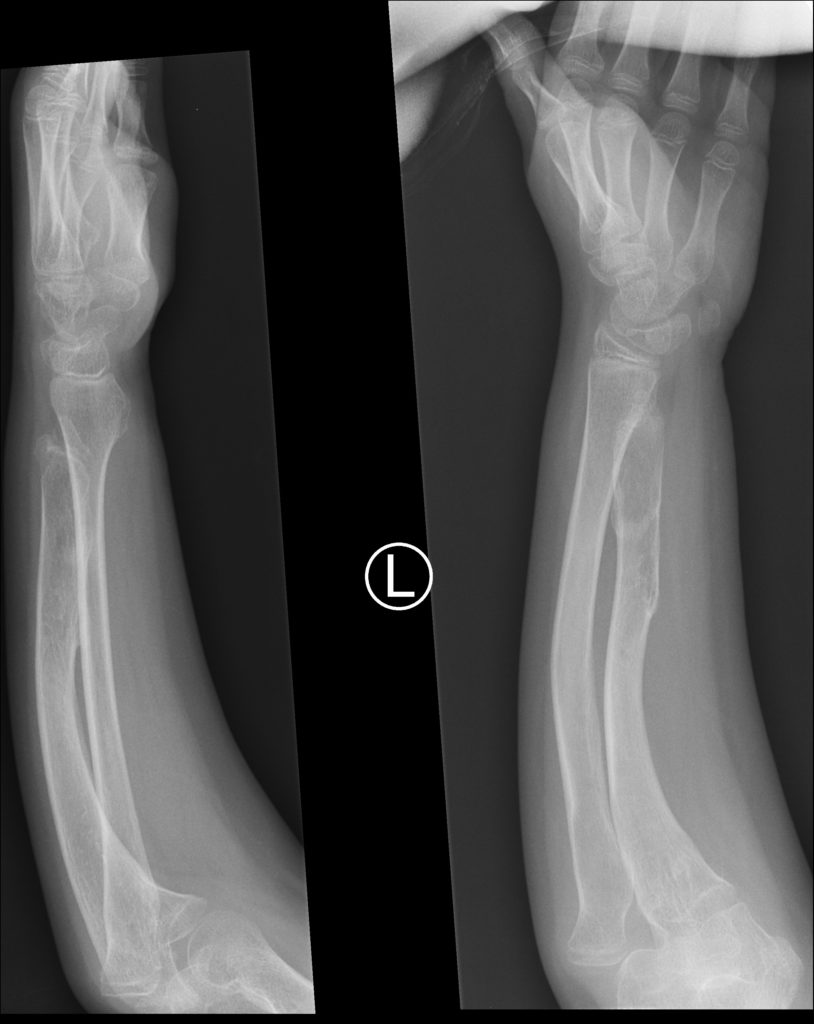
Typową deformacją jest skrócenie kości łokciowej prowadzące do wygięcia łukowatego kości promieniowej z następowym zwichnięciem w stawie ramienno-promieniowym. Może to prowadzić do niestabilności nadgarstka, bólu nadgarstka i łokcia, zmian zwyrodnieniowych w obrębie łokcia , osłabienia siły chwytu oraz zaburzeń rotacji przedramienia. Mechanizm powstawania tego zniekształcenia opisał w swojej pracy Masada i wsp. Pierwotnie dochodzi do uszkodzenia chrząstki wzrostowej kości łokciowej i jej skrócenia a następnie do pociągania przez tkanki miękkie, a głównie błonę międzykostną rosnącej kości promieniowej, co powoduje jej wygięcie i zaburzenia wzrostu. Ostatnim etapem jest zwichnięcie w obrębie łokcia w stawie ramienno-promieniowym. Proces ten został zobrazowany na poniższym schemacie:
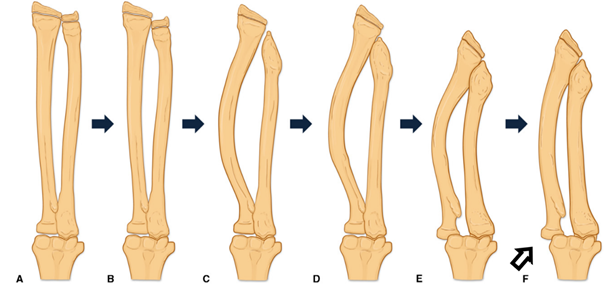
Gottschalk HP, Kanauchi Y, Bednar MS, Light TR .J Hand Surg Am. 2012 Nov;37(11):2286-93.Effect of osteochondroma location on forearm deformity in patients with multiple hereditary osteochondromatosis.
Uważa się, że największe ryzyko wystąpienia podwichnięcia stawu ramienno-promieniowego (oznaczone czarno-białą strzałką) występuje u pacjentów z izolowanymi wyroślami dalszego końca kości łokciowej, gdyż to one uszkadzają dalszą chrząstkę wzrostową doprowadzając do skrócenia kości łokciowej.
Poniżej wymienię jedynie kilka metod pozwalających zapobiec podwichnięciu lub leczyć zastarzałe zwichnięcia stawy ramienno-promienowego.
- Metoda tzw. jednej kości ( one-bone) opisana w 1921 roku przez Grovesa i rekomendowana w 1952 przez Vitale polega na resekcji zniekształconego końca bliższego kości promieniowej i dalszego kości łokciowej, w celu wytworzenia jednej kości. Jest to metoda ostateczna zarezerwowana jedynie dla bardzo skomplikowanych przypadków, w sposób istotny naruszająca biomechanikę przedramienia.
- Resekcja głowy kości promieniowej z interpozycją tkanek i rekonstrukcja LUCL (Lateral ulnar collateral ligament – więzadło poboczne boczne łokcia jest tzw. procedurą ratunkową. Oznacza to, że nie jesteśmy już w stanie uratować zdegenerowanej głowy kości promieniowej i decydujemy się na jej całkowite usunięcie
- Metoda Hirayamy bardzo wartościowa metoda pozwalająca na ustabilizowanie nawykowego podwichania głowy kości promieniowej lub nawet nastawienia jej zwichnięcia we wczesnej fazie drogą specjalnej osteotomii ( przecięcia kości) kości łokciowej
- Wydłużanie kości łokciowej – metoda poddawana w piśmiennictwie pewnej krytyce ze względu na problemy z regeneratem ( kością powstałą wskutek wydłużenia) typu opóźnionego zrost, powstawania stawu rzekomego lub złamania regeneratu. Niezwykle istotna jest dobra kwalifikacja pacjenta i poinformowanie go o możliwych powikłaniach.
Staw skokowy
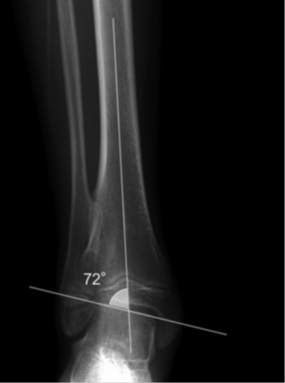
Wyrośla są często powodem powstawania koślawości stawu skokowego. Często lokalizują się w bocznej części przynasady kości piszczelowej lub przyśrodkowej części dalszej części strzałki. Poprzez pociąganie tkanek miękkich dochodzi do samoczynnego zablokowania wzrostu bocznego przedziału stawu skokowego i jego skoślawienia. Niezwykle istotny jest pomiar kąta piszczelowo-skokowego. Rozwiązaniem są zabiegi operacyjne. Istotny jest wiek rozpoznania zaburzenie osi. Poza bezpośrednim usunięciem wyrośli deformującej oś, w okresie wzrostu kośćca możemy się zdecydować na zabieg hemiepifizjodezy – czyli jednostronnej czasowej lub trwałej blokady chrząstki. Dzięki temu zabiegowi, o ile zostanie wykonany w odpowiednim czasie można doprowadzić do naturalnego wyrównania osi. U pacjentów, którzy zakończyli wzrost kostny pozostaje możliwość wykonania korekcyjnej osteotomii nadkostkowej.
Skolioza i wyrośla w obrębie kanału rdzeniowego
Częstość skoliozy młodzieńczej w populacji to ok.2 % podczas gdy u pacjentów z MHO sięga 70 %. Również charakter skoliozy jest odmienny gdyż jest to najczęściej skolioza prawowypukła ze szczytem na przejściu piersiowo-lędźwiowym lub w odcinku lędźwiowym.
Wyrośla kanału kostnego są najczęściej bezobjawowe, jeśli jednak uciskają struktury nerwowe prowadzą do zaburzeń neurologicznych. Wszystkie objawowe wyrośla wymagają obligatoryjnego usunięcia. Zabiegi te najczęściej dają bardzo dobre wyniki. Leczenie bezobjawowych wyrośli wewnątrz kanału rdzeniowego jest kontrowersyjne. Większość autorów skłania się do ich obserwacji i monitorowania przy pomocy MRI.
Transformacja nowotworowa
Chondrosarcoma czyli miesak chrzęstnopochodny występuje u 2-5% pacjentów z HMO a do zezłośliwienia wyrośli czyli kostniakochrzęstniaka dochodzi głownie w 2-4 dekadzie życia. Większe ryzyko transformacji nowotworowej występuje u mężczyzn oraz przy mutacji w obrębie genu EXT 1. Do transformacji najczęściej dochodzi w obrębie bliższej części kości udowej i miednicy. Pierwszymi objawami są stały ból i obrzęk tkanek miękkich. Niestety lokalizacja w miednicy i biodrze jest lokalizacja podstępna, gdyż są to rejony trudno dostępne obserwacji i badaniu klinicznemu. Rozważa się wprowadzenie badań skreeningowych pacjentów z HMO po 20 roku życia czyli – wykonywanie rezonansu magnetycznego MRI raz do roku. Nie został osiągnięty konsensus czy powinno być to badanie całego ciała – tzw. whole body MRI (WBMRI) czy rezonans najbardziej zagrożonej okolicy czyli bioder i miednicy .
Po rozpoznaniu mięsaka chrzęsnopochodnego podstawą leczenia jest szeroka resekcja (wycięcie) chirurgiczne. Chondrosarcoma w zasadzie nie reaguje na leczenie chemio- i radioterapeutyczne, na szczęście cechuje się głównie miejscową złośliwością rzadko dając przerzuty odległe.
Farmakoterapia
Od roku 2014, wielką nadzieją rodziców dzieci z HMO były badania nad lekiem – Palovarotenem zaprezentowanym przez firmę Clementia Pharmaceuticals z grupy Roche, który z powodzeniem przechodził kolejne etapy badań klinicznych. Palovaroten jest agonistą receptora gamma kwasu retinowego i podczas badań na myszach oraz eksperymentalnych grupach pacjentów okazał się skutecznie powstrzymywać formowanie wyrośli oraz poprawiał funkcję stawów. Niemniej jednak 6 grudnia 2019 firma Ipsen (nowy właściciel Clementia Pharmaceuticals) ogłosił wstrzymanie III fazy badań, gdyż lek toksycznie oddziaływał na chrząstkę wzrostową dzieci oraz błonę maziową stawów. U pacjentów poniżej 14 roku życia powodował trwałe i nieodwracalne uszkodzenie chrząstki wzrostowej kości. W związku z przerwaniem dalszych badań jedynym obecnie dostępnym leczeniem przyczynowym jest usunięcie chirurgiczne wyrośli.
Oprac. dr n. med. Artur Oberc